PTC 01/2018
RESUMO EXECUTIVO
Tecnologia: Temozolomida
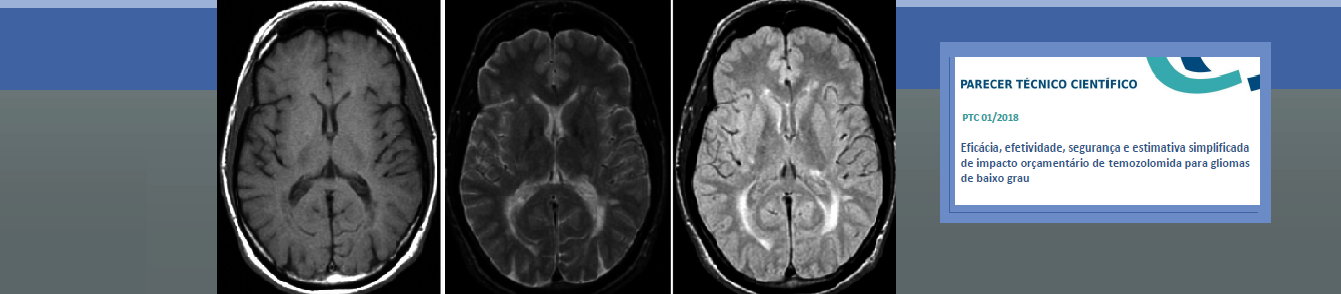
Indicação: Tratamento de gliomas de baixo grau (astrocitoma grau II, oligodendroma grau II e oligoastrocitoma grau II) em adultos.
Caracterização das tecnologias: A temozolomida é um fármaco desenvolvido originalmente pelo laboratório farmacêutico Schering-Plough, que pertence ao grupo farmacoterapêutico dos agentes antineoplásicos – outros agentes alquilantes. É utilizada pela via intravenosa e oral. O uso da temozolomida é mais eficaz, efetivo e seguro que a radioterapia isolada após o tratamento cirúrgico de glioma de baixo grau após a cirurgia, ou após a progressão da doença com a radioterapia após a cirurgia em adultos?
Busca e análise de evidências científicas: Foram pesquisadas as bases eletrônicas Cochrane Library, Medline (Pubmed), LILACS e EMBASE. Foi incluído um ensaio clínico randomizado sobre temozolomida em monoterapia comparada à radioterapia isolada; um ensaio clínico sem braço de comparação e um estudo de coorte não concorrente com braço de comparação que avaliaram a temozolomida concomitantemente à radioterapia; e dois estudos de coorte não concorrente sem braço de comparação sobre a temozolomida após a progressão da doença com radioterapia. Os estudos avaliaram o medicamento por via oral para os seguintes gliomasde grau II: astrocitoma, oligodendroma e oligoastrocitoma. Estudos sem braço de comparação foram considerados para a análise de desfechos de segurança. Foram utilizadas as ferramentas de risco de viés da Colaboração Cochrane e escala
Newcastle-Ottawa para verificar a qualidade metodológica dos estudos incluídos. Adicionalmente, foram consultadas agências internacionais de Avaliação de Tecnologias da Saúde (ATS) para verificar suas recomendações sobre uso da temozolomida para gliomas.
Resumo dos resultados dos estudos selecionados: Segundo a ferramenta de risco de viés da Colaboração Cochrane, os ensaios clínicos incluídos apresentaram, em geral, alto risco de viés, o que pode levar a superestimação do efeito. Os estudos de coorte incluídos apresentaram, de maneira geral, baixa qualidade metodológica segundo a ferramenta Newcastle-Ottawa. Para a temozolomida em monoterapia em comparação com a radioterapia isolada, no ensaio clínico randomizado aberto EORTC 22033–2603 não foram verificados resultados estatisticamente significantes para os desfechos de maior relevância: sobrevida global (SG) e sobrevida livre de progressão (SLP), e a segurança foi pior com a temozolomida. Para temozolomida concomitantemente à radioterapia, no estudo observacional de Gai et al. (2016), a SLP foi maior para os pacientes que utilizaram temozolomida concomitante à radioterapia que para os pacientes que utilizaram a radioterapia isolada. No entanto, não houve diferença entre os grupos quanto à SG. No ensaio clínico sem braço de comparação RTOG 0424, a frequência de eventos adversos com temozolomida e radioterapia foi superiores aos esperados apenas com a radioterapia, entretanto toxidades tardias graves não foram observadas. Para a avaliação do tratamento após a progressão com radioterapia foram incluídos dois estudos observacionais sem braço de comparação, conduzidos por Chamberlain, (2008) e Taal et al., (2011), os quais não suportam a indicação de temozolomida neste contexto.
Recomendações: Os gliomas de baixo grau são os tumores primários mais prevalentes do sistema nervoso central, destacando-se o astrocitoma, oligodendroma e oligoastrocitoma. As Diretrizes Diagnósticas e Terapêuticas (DDT) do Tumor Cerebral no Adulto do Ministério da Saúde, de 2012, elencam como principal tratamento para gliomas de grau II a cirurgia, se o tumor foi completamente ressecável, ou cirurgia seguida por radioterapia, se houver confirmação ou suspeita de tumor residual. Em 2014, a Comissão Nacional de Incorporação de Tecnologias do SUS (CONITEC) avaliou e não recomendou a incorporação de temozolomida para o tratamento de gliomas de alto grau (III e IV), para os quais há indicação de quimioterapia segundo a DDT. Do ponto de vista da análise do impacto orçamentário, embora com um baixo nível de evidência, foi simulado o cenário para o uso de temozolomida no contexto após a cirurgia e concomitantemente à radioterapia, no qual foi estimado um custo incremental, em cinco anos, entre R$ 121 milhões e R$ 154 milhões. Com as evidências científicas levantadas por esse PTC, em sua maioria de baixa qualidade metodológica, e considerando os resultados de sobrevida global, concluímos pela recomendação contra o uso da temozolomida em monoterapia após a cirurgia (evidência forte); recomendação contra do uso da temozolomida concomitante à radioterapia após a cirurgia (evidência de baixa qualidade); e recomendação contra o uso da temozolomida em monoterapia após a progressão da doença com radioterapia (evidência de baixa qualidade).















Adicionar Comentário